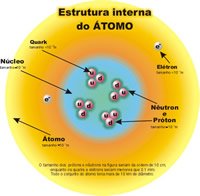
NÚMERO ATÓMICO, NÚMERO MÁSICO E ISÓTOPOS
Es el número de protones que tiene un átomo y se representa con Z. Como los átomos son neutros, Z nos indica en cierto modo el número de electrones. Por tanto,
La suma del número de protones y neutrones se denomina Número Másico: (A).
Simbólicamente cada núcleo de un determinado elemento indicando el número atómico y el número de protones se representaría así:



Número de masa = Número de protones + Número de neutrones
O lo que es lo mismo:
A = Z + N
Número de Neutrones = Número de masa – Número de protones
N = A - Z
¿Pero qué puede suceder cuando ocurra que haya varios átomos diferentes, pero todos ellos con un protón en su núcleo?. ¿Que elemento sería? Todos serían Hidrógeno, ya que como se ha dicho, el número atómico determina el elemento que se trata, ahora, es importante tener en cuenta que, quizá la diferencia entre dichos átomos estribe en el número de neutrones. Cada una de estas especies, que son diferentes, pero que todas son el elemento hidrógeno, se llaman isótopos.
Los isótopos son átomos que tienen el mismo número atómico (se trata del mismo elemento), pero distinto número másico, es decir, tienen diferente el número de neutrones. Como ejemplo, se tiene el Hidrógeno y sus 3 isótopos, el Protio, el Deuterio y el Tritio; los 3 tienen el mismo número atómico de 1 porque poseen un sólo protón en el núcleo.
· El isótopo con A = 1, denominado protio, que carece de neutrones.
· El isótopo con A = 2, llamado deuterio (que posee un neutrón).
· El isótopo con A = 3, denominado tritio, que posee dos neutrones.

Para referirse a un determinado isótopo, se escribe así: .
 Aquí X es el símbolo químico del elemento, Z es el número atómico, y A es el número de neutrones y protones combinados, llamado el número de masa. Por ejemplo, el hidrógeno ordinario se escribe:
Aquí X es el símbolo químico del elemento, Z es el número atómico, y A es el número de neutrones y protones combinados, llamado el número de masa. Por ejemplo, el hidrógeno ordinario se escribe:
EL deuterio es:

El titrio es:

a. Medicina Nuclear. Se ha extendido el uso de radiaciones y de radioisótopos en medicina como agentes terapéuticos y de diagnóstico. En el diagnóstico se utilizan radiofármacos para diversos estudios como: Tiroides, Hígado, Riñón, Metabolismo, Circulación sanguínea, Corazón, Pulmón.
b. Radioinmunoanálisis. Es un método de gran sensibilidad utilizado para realizar mediciones de hormonas, enzimas, virus de la hepatitis.
c. Radiofármacos. Se administra al paciente un cierto tipo de fármaco radioactivo que permite estudiar mediante imágenes bidimensionales o tridimensionales (tomografía) el estado de diversos órganos del cuerpo humano.
EJEMPLO
Número de neutrones (N) = Número de masa – Número de protones
N = A – Z, por lo tanto, N = 60 – 30 = 30 neutrones.
Un núcleo se considera estable si no se transmuta espontáneamente en 1021años, si bien puede transmutarse en otros núcleos bajo ciertas condiciones.
Hay 118 elementos químicos conocidos hasta la fecha (Abril de 2007), de los cuales, 92 existen en la naturaleza y el resto han sido obtenidos artificialmente. Se conocen hoy en día unos 2000 núclidos, de los cuales son estables 274. Unos 340 existen en la Naturaleza y el resto se han producido en el laboratorio. Por tanto, la mayoría de los núclidos son radiactivos.
Los núclidos radiactivos son inestables y se transforman espontáneamente con el tiempo formando otros núclidos.









![[5,6]fullerene-C78-D3h(II), Fullereno con 78 átomos de carbono](http://photos1.blogger.com/x/blogger2/5193/54604907847222/760/z/229249/gse_multipart55314.png)
![[5]fullerene-C20-Ih](http://photos1.blogger.com/x/blogger2/5193/54604907847222/760/z/164338/gse_multipart55323.png)
![[4,6]fullerene-C24-Oh, Fullereno con 24 átomos de carbono](http://photos1.blogger.com/x/blogger2/5193/54604907847222/760/z/872213/gse_multipart55329.png)
